Какво е изобарен топлина 1
На вътрешната енергия на телата
Според MKT всички вещества се състоят от частици, които са в непрекъснато топлинно движение и да си взаимодействат един с друг. Следователно, дори ако тялото е неподвижно и нула потенциална енергия има енергия (вътрешен енергиен), което е общата енергия на движението и взаимодействието на микрочастиците, съставляващи тялото. Структурата на вътрешната енергия включва:
- кинетичната енергия на транслацията, въртене и вибрационното движение на молекулите;
- потенциалната енергия на взаимодействието на атоми и молекули;
- в-атом и на ядрената енергия.
В термодинамиката счита процесите при температура, при която не колебателно движение се възбужда атома в молекулата, т.е. при температура не повече от 1000 К. само първите два компонента на климата във вътрешната енергия на тези процеси. следователно
при вътрешна енергия в термодинамиката разбере сумата от кинетичната енергия на молекулите и атомите на тялото и потенциалната енергия на взаимодействието им.
Вътрешният енергията на тялото определя термичното състояние и се променя по време на прехода от едно състояние в друго. В това състояние, тялото има добре дефинирана вътрешна енергия не зависи от това дали, в резултат на процеса той се превърна в това състояние. Ето защо, на вътрешната енергия често се нарича като функция на състоянието на тялото.
Изчислете вътрешна енергия само за идеален газ, тъй като молекули не взаимодействат един с друг и тяхната потенциална енергия е равна на нула:
U = \ dfrac \ cdot \ dfrac \ cdot R \ cdot T \)
където аз - степента на свобода. За едноатомен газ (например инертен газ) I = 3 за двувалентни - аз = 5.
Това се вижда от тези формули, че вътрешната енергия на идеалния газ зависи само от температурата и броят на молекули и е независим от обема или налягане. Следователно, промяната във вътрешната енергия на идеалния газ се определя от само промяна в температурата и е независимо от естеството на процеса, в който газът преминава от едно състояние в друго:
\ Delta U = U_2 - U_1 = \ dfrac \ cdot \ dfrac \ cdot R \ cdot \ Delta T \)
- недвижими газови молекули взаимодействат помежду си и по този начин имат потенциална енергия WP. който зависи от разстоянието между молекулите и следователно обемът заето от газа. Така вътрешната енергия на реалния газ зависи от температурата, обема и структурата на молекулите.
* Произхода на
Средната кинетичната енергия на молекула \ (
\ Ляв \ langle W_k \ прав \ rangle = \ dfrac \ cdot к \ cdot T \).
Броят на молекули в газ \ (
N = \ dfrac \ cdot N_A \).
Вследствие на това на вътрешната енергия на идеален газ
U = N \ cdot \ ляво \ langle W_k \ полето \ rangle = \ dfrac \ cdot N_A \ cdot \ dfrac \ cdot к \ cdot Т. \)
Като се има предвид, че k⋅NA = R - универсална газова константа, ние имаме
U = \ dfrac \ cdot \ dfrac \ cdot R \ cdot T \) - вътрешната енергия на идеалния газ.
Промяната в вътрешна енергия
За да се реши практически въпроси, той играе важна роля не на вътрешната енергия и нейната промяна ΔU = U2 - U1. Промяната в вътрешна енергия се изчислява от закона за запазване на енергията.
На вътрешната енергия на тялото може да се променя по два начина:
- При извършване на механична работа. а) Ако външната сила предизвиква деформация на тялото, при което промяната на разстоянието между частиците от които се състои, и следователно варира потенциалната енергия на частиците на взаимодействие. Когато нееластични деформации, освен това, телесната температура варира, т.е. промяна на кинетичната енергия на топлинна движение на частиците. Но работата се извършва при деформация на тялото, което е мярка за промяната във вътрешната енергия на тялото. б) Вътрешна енергия на тялото също варира в зависимост от неговата нееластично сблъсък с друго тяло. Както видяхме преди, тяхната кинетична енергия нееластично сблъсък на органи се намалява, тя се превръща в вътрешния (например, ако ви удари няколко пъти с чук върху телена лежи върху наковалнята - жицата загрява). Мярка за промяна на кинетичната енергия на тялото, според теоремата на кинетичната енергия, работата на действащите сили. Тази работа може да служи като мярка за промяната във вътрешната енергия. в) на вътрешната енергия на промяната на тялото възниква под влиянието на силите на триене, тъй като е известно, от опит, триене винаги е придружен от промяна в температурата на телата на триене. силата на триене работа може да служи като мярка за промяната във вътрешната енергия.
- С помощта на топлина. Например, ако тялото се поставя в пламъка на горелката, промяната на температурата, следователно, да се промени и вътрешната си енергия. Въпреки това, няма работа не се извършва, защото никой не вижда движението на основния текст или нейни части.
Промяната във вътрешната енергия на системата, без работа, наречена топлообменен (пренос на топлина).
Има три вида на пренос на топлина: проводимост, конвекция и излъчване.
а) топлина проводимост се нарича процес за пренос на топлина между телата (или части на тялото) при тяхната директна връзка, причинени от случайни топлинна движение на частиците в тялото. Амплитудата на колебание на твърдо тяло на молекулите е по-голяма, колкото по-висока температурата. Топлопроводимостта на газове, дължащи се на обмен на енергия между газови молекули в сблъсъци. двете механизми работят в случай на течности. Топлопроводимостта на твърди вещества максимални и минимални в газообразно състояние.
б) прехвърляне на конвекция на топлина е отопляем течни или газови потоци от един обем порции заети от тях в други.
в) прехвърляне на излъчване на топлина се извършва на разстояние с помощта на електромагнитни вълни.
Помислете за по-подробно начините за промяна на вътрешната енергия.
механична работа
При разглеждане на термодинамичните процеси на механично движение на макроскопични тела не се смята като цяло. Концепцията на работа е свързана с промяна в обема на тялото, т.е. macrobody движещи се части една спрямо друга. Този процес води до промяна в разстоянието между частиците, а също така често да се промени скоростта на тяхното движение, като по този начин, промяна на вътрешната енергия на тялото.
изобарен процес
Нека първо да обмислят изобарно процес. Да предположим, че в цилиндър с подвижно бутало е газ при температура Т1 (фиг. 1).
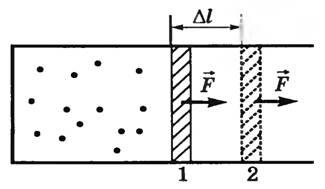
Ние бавно нагряване на газ до температура Т2. Изобарно газ ще се разшири и в движение на буталото от позиция 1 до позиция 2 от разстояние Δl. Силата на налягането на газа по този начин работи на външни органи. Тъй като р = конст, след това силата на натиск F = p⋅S също постоянна. Ето защо, работата на тази сила може да бъде изчислена по формулата
А = F \ cdot \ Delta л = р \ cdot S \ cdot \ Delta л = р \ cdot \ Delta V, \)
където ΔV - промяна на обема на газ.
- Ако обемът на газ не се променя (изохорен процес), експлоатация газ е нула.
- Газ работа само в процеса на промяна на обема си.
При разширяване (ΔV> 0) е положителна работа газ (> 0); На натиск (ΔV <0) газа совершается отрицательная работа (А <0).
- Ако говорим за работата на външни сили A '(A' = -А), след разширяването (ΔV> 0) на газ А " <0); при сжатии (ΔV <0) А '> 0.
уравнение на Менделеев-Клапейрон газ в продължение на две държави:
р \ cdot V_1 = \ пи \ cdot R \ cdot T_1, \; \; р \ cdot V_2 = \ пи \ cdot R \ cdot T_2 \)
р \ cdot (V_2 - V_1) = \ пи \ cdot R \ cdot (T_2 - T_1) \).
Следователно, когато изобарен процес
А = \ пи \ cdot R \ cdot \ Delta Т. \)
Ако ν = 1 мол, когато ΔΤ = 1 За да се получи, че R е числено равно А.
Следователно физическия смисъл на универсалната газова константа. Тя е числено равна на работата, извършена от един мол идеален газ при изобарен загряване на 1 К.
Не е изобарен процес
графика Р (V) съгласно изобарен процес на работа е равна на защрихованата зона на фигура 2, и правоъгълник.
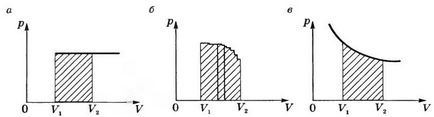
Ако процесът е изобарно (фиг. 2Ь), кривата на функцията р = F (V) могат да бъдат представени като прекъсната линия, състояща се от голям брой isochors и isobars. Работата по изохорен секции е нула, а общият работа във всички области ще бъде равен изобарен
А = \ lim_ \ сума ^ n_ p_i \ cdot \ Delta V_i \), или \ (
А = \ Int р (V) \ cdot DV \)
т.е. Тя ще бъде равна на площта на сенчестата фигурата.
Когато изотермичен метод (Т = конст) работа е равна на площта на защрихованата форма, показана на фигура 2, инча
Определя операция, като се използва горната формула, може да се използва само когато тя е известна като газ под налягане варира с неговия обем, т.е. позната форма на функцията р = F (V).
По този начин, се вижда, че дори и при същата промяна в работен обем на газ ще зависи от процеса на преход (т.е., от процеса: изотермична, изобарно, ...) от първоначалното състояние на крайния газ. Следователно, можем да заключим, че
- Работата в термодинамиката е функция на процеса и не е функция на държавата.
Количеството топлина
Както е известно, при различни механични процеси променя механична енергия W. промени мярката в механична енергия се работни сили, приложени към системата:
Когато предаването на топлина променя вътрешната енергия на тялото. Мярката за промяна на вътрешната енергия в топлообмен количеството топлина е.
Количеството топлина - мярка за промяната във вътрешната енергия в процеса на топлообмен.
По този начин, както в работата и количеството на топлинна енергия се характеризира с промяна, но не идентичен на вътрешната енергия. Те не се характеризират състоянието на самата система (също както и вътрешната енергия), както и определяне на енергийния преход от една форма в друга (от един орган на друг), когато държавата и по същество зависи от естеството на процеса.
Основната разлика между работата и количеството топлина, е, че
- работа описва процеса на промяна на вътрешната енергия на системата, придружен от превръщане на енергия от една форма в друга (поради вътрешния механични);
- количество топлина характеризира вътрешен трансфер на енергия от едно тяло на друго (от повече нагрява до по-малко нагрява) не се придружава от енергийните трансформации.
Отопление (охлаждане)
Опитът показва, че количеството топлина, необходима за нагряване на телесна маса м от температура Т1 до температура Т2. Тя се изчислява по формулата
Q = С \ cdot m \ cdot (T_2 - T_1) = C \ cdot m \ cdot \ Delta T \)
където С - специфичната топлина на веществото (таблична стойност);
Единицата за специфична топлина на SI е джаул на килограм-Келвин (J / (кг · K)).
Специфична teploemkostc числено равно на количеството топлина, което трябва да се даде на телесна маса от 1 кг, да се загрява с 1 К.
Освен това, специфичната топлина и стойност като тялото топлинен капацитет.
Специфичната топлина С тялото е числено равно на количеството топлина, необходима за промени в температурата на тялото от 1 К:
телесната топлина за единица в SI е джаул на Келвин (J / K).
Изпаряване (кондензация)
За превръщането на течност в количество пара постоянна температура топлина необходимо да се изразходва
където L - специфичната топлина на изпарение (таблична стойност). Кондензация на пара се отделя същото количество топлина.
Единицата за специфична топлина на изпарение е в SI джаула на килограм (J / кг).
Температура на топене (кристализация)
За да се стопи кристална маса м при температурата на топене на тялото, тялото трябва да докладва количеството топлина
Q = \ ламбда \ cdot m \)
където λ - топлина на стапяне (таблична стойност). същото количество топлина се освобождава по време на кристализацията тяло.
Единицата за специфична топлина на топене е в SI джаула на килограм (J / кг).
изгаряне на горивото
Количеството топлина, която се освобождава по време на пълното изгаряне на маса гориво м.
където Q - специфична топлина на изгаряне (таблична стойност).
Единицата за специфична топлина на изгаряне е в SR джаула на килограм (J / кг).