Термодинамични процеси идеалните газове
Характеристики на основните видове термодинамични процеси на идеалните газове с промени в параметри като температура, обем, налягане и газ, произведен работа.
Видове процеси. Основните процеси в инженерните термодинамиката, много важни както теоретично, така и прилаганите начини, са:
Хелмхолц - протичащ при постоянен обем;
изобарно - протичащ при постоянно налягане;
изотермични - протичащ при постоянна температура;
адиабатно - при които няма топлообмен с околната среда;
политропно - удовлетворява уравнението PV п = CONST.
Първите четири процеси са особени случаи на процеса на политропно.
В изследването на тези процеси се определя по уравнението на процес координира р, V и Т, S, комуникацията между държавните газ параметри, измерване на вътрешната енергия, големината на външната работа и количеството топлина абстрахира.
Изохорен процес. Когато изохорен състояние процес DV = 0 или V = конст. идеален уравнение газ, който
т.е. Газ налягане е право пропорционална на неговата абсолютна температура:
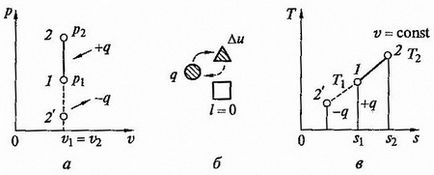
Фиг. 2.4 изохорен процес на р - V и Т - и диаграми (а, в) и енергиен баланс верига (б)
Графики на процеса на р - V и Т - S - диаграми, както и енергиен баланс верига е показано на фиг. Работа разширяване в този процес е нула, тъй като DV = 0. количеството топлина, подавана към работния флуид в продължение на 1 - 2 CV = конст. определя от съотношението
От л = 0. След това, в съответствие с първия закон на термодинамиката
Изобарен процес. Наречен изобарен процес се осъществява при постоянно налягане. От идеален газ уравнение на състоянието, когато р = конст намерите
т.е. В обема на изобарен процес газ пропорционална на абсолютната температура (закон Gay-Lussac му). Графики на процеса на р - V и Т - S - диаграми, и ttakzhe znergoballansa схема, показана на Фиг. 2.5.
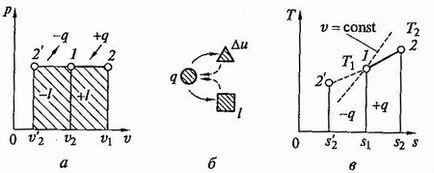
Фигура 2.5. Изобарен процес на р - V и Т - S - диаграми (а, в) и енергиен баланс верига (б)
Количеството топлина, действаща на газ при нагряване (или при охлаждане да им се даде) е намерена от уравнението
Изотермични процес. При постоянна температура процес изотермични, следователно, PV = RT = конст или р2 / p1 = V1 / V2. т.е. налягане и обем са обратно пропорционално един до друг, така че изотермични компресия на повишаване на налягането на газ, и по време на разширение - попада (Boyle - Mariotte).
Графиката на изотермичен метод в координати р, о (Fig.2.6, а) е равнобедрен хипербола, за които координатните оси са asimptomami.
Тъй като енергията не се променя, след това вътрешната енергия на идеалния газ в процеса остава постоянно (Δu = 0) и цялата топлинна енергия за газа е напълно превръща в работа разширяване р = л.
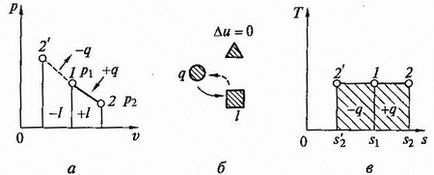
Фиг. 2.6. Изотермична процес р - V и Т - S - диаграми (а, в) и енергиен баланс верига (б)
За изотермичен компресия на топлината се извежда газ в размер, равен на стойността на работата на компресията. Схемата и графика на енергийния баланс и изобарен процес Т -s - схема, показана на фиг. 2,6, Ь, с.
Адиабатно процес. Процес, наречен адиабатни промени в състояние газ, което се случва, без топлообмен с околната среда. Този процес съответства на случая, когато контейнерът или плика обхващащ газ, термично изолиран от околната среда. За този случай уравнението на първия закон на термодинамиката, тъй като тя usloviyudq = 0 на приема формата
Това означава, че в процеса на адиабатно работа експанзия се извършва само чрез прекарване на вътрешна енергия на газа и че компресията, която се провежда от действието на външни сили, цялата работа се извършва от тях, за да се увеличи на вътрешната енергия на газа.
Означаваме специфичната топлина в адиабатен процес през градината и изричното условие дю = 0, както следва:
Това състояние показва, че специфичната топлина в адиабатен процес е равна на нула, т.е. Garden = 0. Известно е, че
Уравнение адиабатен процес крива (адиабатно) в координати р, о (Fig.2.7 а) има формата
където к - се нарича адиабатно индекс (тази стойност също се нарича съотношение на Поасон).
т.е. процес техническа адиабатно разширение работа е равна на енталпията разлика от началото и в края на процеса.
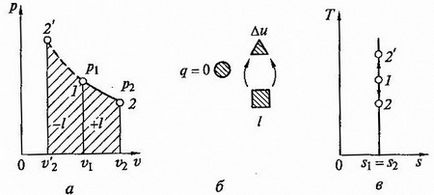
Fig.2.7 Adiabptny процес р - V и Т - S liagrammah (а, в) и енергиен баланс верига (б)
Адиабатно процес случва без вътрешно триене в работната течност, се нарича изоентропен. В T -s схема (фигура 2.7, в) е представено с вертикална линия.
Обикновено истинските адиабатни процеси се извършват в присъствието на вътрешното триене в работния флуид, при което топлината винаги се освобождава, което незабавно се съобщава на работния флуид. В този случай, DS> 0, процесът се нарича действителна адиабатен процес.
Политропен процес и обобщаване стойност. Наречен политропно процес, който протича при постоянна топлинен капацитет и е описан от уравнението
Политропен експонат п може да приеме всяка числова стойност в диапазона от -∞ до + ∞, но е постоянна за даден процес.
От уравнение (2.13) и уравнението на Клапейрон е лесно да се получи изрази, свързани с PV и Т на всеки две точки на политропен:
Политропен процес е обобщение на стойността за покриване на съвкупността от основните термодинамични процеси.