Кинетиката на ензимни реакции 1
Ензимни кинетика изследва ефекта на химичното естество на реагиращите вещества (ензими, субстрати) и техните условия за взаимодействие (концентрация, рН, температура, присъствие на активатори или инхибитори) Скоростта на ензимната реакция. Скоростта на ензимната реакция (V) се измерва чрез намаляване или увеличаване на количеството на субстрата продукт за единица време.
Когато катализа ензимно, ензимът (Е) е обратимо свързана със субстрата (S), образуване на преходен ензим-субстрат комплекс (ES), която в края на реакцията, се разлага с освобождаването на ензима (Е) и реакционните продукти (F):
Важна особеност на ензимни реакции - насищане на ензима субстрат. При ниски концентрации на субстрат скоростта на реакцията е директно пропорционална на концентрацията му. При високо - максимална скорост реакция става постоянно и независимо от концентрацията на субстрат [S] и е напълно определена чрез ензимна концентрация (Фигура 11.).
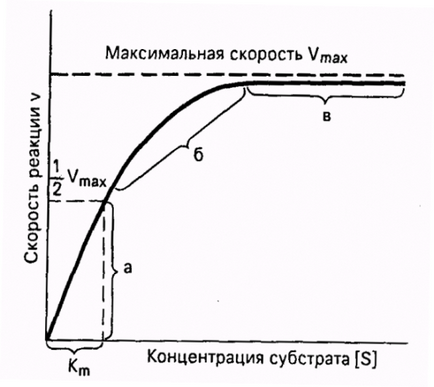
Фиг. 11. Зависимост на ензимната скорост на реакцията на концентрацията на субстрата при постоянна концентрация на ензим.
KS - константа на дисоциация на ензим-субстрат сложни ES, обратни константа на равновесие:
Колкото по-малка KS на стойност. толкова по-голям афинитет на ензима към субстрата.
Количественото връзката между концентрацията на субстрат и ензим скорост на реакцията изразява Michaelis-Menten уравнение:
,
ф - скоростта на реакция, Vmax - максималната скорост на ензимна реакция.
Briggs и Халдейн подобрена уравнението, като напишете това Михаелис постоянна КМ. определена експериментално.
Уравнение Briggs - Халдейн:
Константата Michaelis е числено равно на концентрацията на субстрат (мол / л), при която степента на ензимната реакция е половината от максималната (фиг. 12). Km показва афинитета на ензима към основата; по-малката си стойност, толкова по-голям афинитет.
Експериментални стойности на Km за повечето ензимни реакции, включващи един субстрат е обикновено 10 -2 -10 -5 М. Ако реакцията е обратима, взаимодействието на ензима със субстрат характеризира чрез директно взаимодействие Km. се различава от това за реакция субстрат обратно.
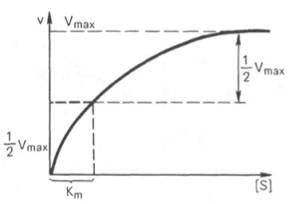
Фиг. 12. Графичен opredeleniekonstanty Михаелис.
Ензимите се различават от конвенционални катализатори, редица свойства.
Thermolability. или чувствителност към повишаване на температурата (фиг. 13).
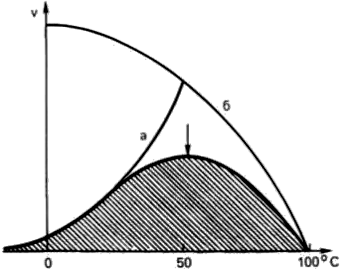
Фиг. 13. зависимост от температурата на скоростта на ензимната реакция.
При температура не повече от 45-50 ° С, най-много биохимични реакции процент се увеличава от 2 пъти, когато температурата се повиши от 10 ° С (обикновено Van't Hoff). При температури над 50 ° С, скоростта на реакцията започва да оказва голямо влияние термично денатуриране на ензима протеин води до пълно спиране на процеса на ферментация.
Температурата, при която каталитичната активност на ензима е максимална, се нарича температура оптимално. Температура оптимално за повечето ензими бозайник е в рамките на 37-40 ° С При ниски температури (0 ° С и по-долу) ензими обикновено не се срине, въпреки че тяхната активност пада до нула.
Зависимостта на активността на ензима на рН на средата (фиг. 14).
има оптимална стойност на рН, при която проявява максимална активност за всеки ензим. рН оптимум на ензимната активност се намира в тесен концентрация група водороден йон, подходящ за животински тъкани работи по време на еволюцията физиологични стойности на рН 6,0-8,0. Изключения са пепсин - 1,5-2,5; аргиназата - 9.5-10.
Според настоящите изглед, ефектът от промените в рН на молекула ензим е изложена на третичната структура на протеина.
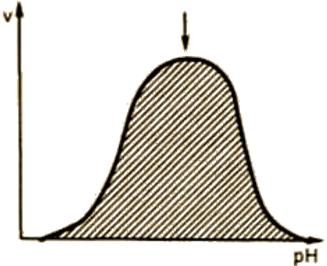
Фиг. 14. Зависимост на ензимната скорост на реакцията на рН.
Специфика. Високата специфичност на действие поради ензими конформационни и електростатичен допълване между молекулите на субстрат и ензим и уникален структурната организация на активното място, осигуряване на селективност на реакцията.
Абсолютната специфичност - sposobnostfermenta катализира една единствена реакция. Например, уреаза катализира реакцията на хидролиза на урея да NH3 и СО2.
Относителна (група) специфичност - способността на ензима да катализират реакции група от определен тип. Относителна специфичност, например хидролитични ензими притежават пептидази хидролизират пептидни връзки в протеинови молекули и пептиди.
Стереохимичната специфичност са ензими, които катализират превръщането на само един от региоизомери. Fumarase ензим катализира превръщането на малат в само транс изомер фумарат и няма ефект върху цис-изомера на малеинова киселина.
Високата специфичност на ензима действие осигурява поток от някои химически реакции на всички възможни трансформации.