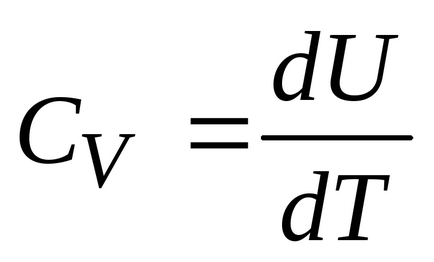изохорен процес
Изохорен процес се извършва при постоянен обем. Натискът върху температурната зависимост е описан от уравнението:
който гласи: за дадена маса на газ при постоянно налягане на обема на газ се увеличава линейно с увеличаване на температурата.
изобарен процес
Изобарен процес. Този процес срещащи се при постоянно налягане, Р = конст.
Зависимост на обема на температура е описан от:
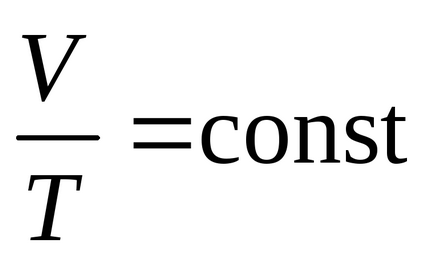
който гласи: за дадена маса на газ при постоянно налягане на обема на газ се увеличава линейно с увеличаване на температурата.
адиабатен процес
Адиабатен процес е процес, който се случва без топлообмен с околната среда (DQ = 0). Той е описан от уравнението на Поасон:
където е константа адиабатен процес. Непрекъснато адиабатен процес е равна на:
В адиабатен процес газ промените всички параметри: налягане, обем и температура.
2. топлина капацитет на газ
Количеството топлина DQ, съобщава тялото чрез нагряване, както и
,
където С - специфичната топлина на веществото. равно на количеството топлина, действаща единица маса на материала да се загрява до известна степен.
В допълнение ще се въведе понятието специфичен топлинен капацитет моларен топлина. Моларното специфична топлина C - равно на количеството топлина предава един мол на веществото да се загрява до известна степен.
моларен специфична топлина капацитет и са свързани с:
където С е моларното топлинен капацитет, - моларната маса.
Газът може да се нагрява при постоянно налягане и при постоянен обем, топлинен капацитет, така че двете са въведени газ: изобарно и изохорен. моларен изобарно и изохорен моларен топлина капацитет на газа, свързана със съответните отношения:
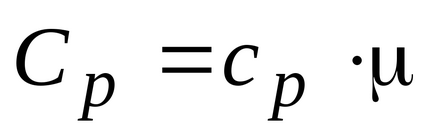
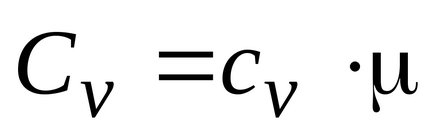
Това показва, че молното съотношение на специфични топлини на газа е отношението на специфични
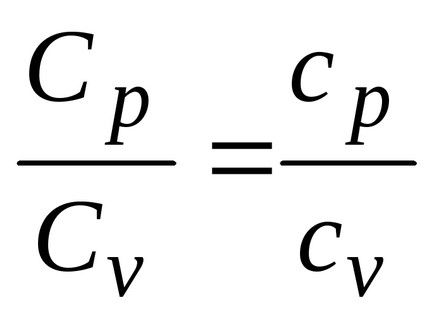
Количеството топлина предава до 1 мол на газ при изохорен процес е:
и изобарен процес
3 Първият закон на термодинамиката
Количеството топлина DQ. Отчетените термодинамична система, се изразходва за повишаване на неговата вътрешна енергия Du и работа Da система срещу външни сили.
Вътрешният енергията на U - общата енергия на всички молекули в газа е идеален газ - кинетичната енергия на въртеливо и постъпателно движение. За един мол газ се определя с израза
Работата, извършена от газа, равна
където DV - промяна на обема си.
Прилагане на първия закон на термодинамиката изотермична процес
В този процес, температурата остава постоянна (Т = конст) В този случай, дТ = 0 и вътрешната енергия не се променя Du = 0 DQ = Da, т.е. цялата топлина газ на входа се консумира за извършване на работа срещу външни сили.
изохорен процес
Когато изохорен процес V = конст, DV = 0 и DA = 0. Т.е. където операция процес не се осъществява, като обем не се променя. След 1 начало е писано:
Т.е. количеството топлина, изразходвано за промяна във вътрешната енергия. Но по дефиниция
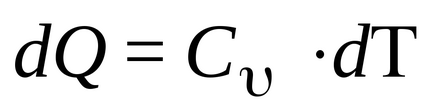
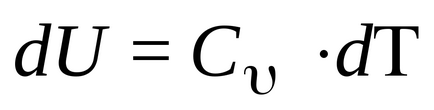
Тази формула показва, че промяната на вътрешната енергия на газа се определя само чрез промяна на температурата. Капацитетът на топлина при постоянен обем (изохорен топлинна мощност) е равен на: