Ензимни кинетика - studopediya
Ензим катализа е значително различен от неензимно и следователно кинетиката на ензимни реакции разработени много специални модели. Те позволяват да се разграничат ензимната кинетика в отделен раздел на химически кинетика, който изследва зависимостта на процента на реакции, катализирани от ензими, концентрацията на реагиращите вещества (ензими и субстрати) и условията на тяхното взаимодействие (температура, рН, концентрация
Коензимите и кофактори, наличието на различни ефекторни: активатори и инхибитори).
Проучването на кинетиката на ензимно действие е от голямо теоретично значение, защото само от гледна точка на кинетика може да се приближи до решаване на въпроса с механизма на действието на ензими. Но също така е необходимо от практическа позиция, като просто като някои данни за кинетиката на действие на определен ензим, е възможно да се избере оптимални условия за нейното функциониране, както и да влияе върху дейността си в дадена посока на различни етапи от процеса.
Въпроси, свързани с кинетиката на ензимни реакции, описани подробно в съответните раздели на биохимията и Enzymology, следователно се фокусира върху тези позиции, които са необходими за компетентен подход за работа с ензими: условията за подбор за определяне на активността на ензима, определяне на началната скорост на ензимната реакция, изборът на субстрата, определяне на неговия наситен концентрация, оптимална температура и рН действие, влияние кофактори, активатори и инхибитори.
Наличието на ензимния разтвор или екстракт може да се определи въз основа на скоростта на реакцията, катализирана от тях, което може да бъде оценена чрез натрупването на реакционни продукти или от загуба на субстрата.
Повечето от ензимната реакция са смесени реакции ред. (. Фигура 8.1) Типична крива курс на ензимната реакция е както следва:
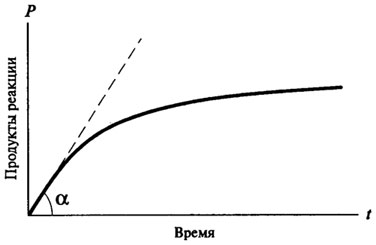
Фиг. 8.1. Кривата на напредъка на времето за ензимна реакция
По този начин, времето на ензимната реакция не може да се опише чрез математическо уравнение, като всички ензимни реакции в началото на възникването им (когато има излишък на субстрата и образуват малки реакционни продукти) са
нулеви реакции ред, и само след като те придобиват характера на реакцията на първи или втори ред. Реакционната нулев порядък с време не се променя, в зависимост от размера на продукт, образуван от време на време е пряко пропорционална на (вж. фиг. 8.2). За реакции на скорост от първи порядък реакция по всяко време е пропорционално на наличната концентрация на субстрата и, следователно, има постоянно намаляване на скоростта на реакцията с течение на времето (вж. Фиг. 8.3).
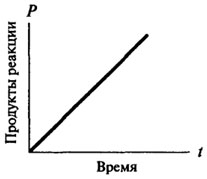
Фиг. 8.2. Графично представяне на реакция на нулев порядък
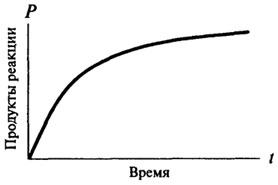
Фиг. 8.3. Графично представяне на реакция от първи порядък
За да се определи точно потенциалът на този ензим като катализатор, е необходимо да се вземе под внимание скоростта на ензимната реакция в момент от времето, когато факторите забавят скоростта на ензимната реакция (липса на субстрат, специфичното инхибиране на реакционните продукти, частичен топлинна денатурация на ензима и т.н.), Не трябва време, за да се покаже ефектът му и има пряка пропорционална връзка между продуктите на реакцията и време.
Тази скорост се нарича първоначалната скорост на реакцията на ензимното и е означен с V0.
На практика V0 се определя чрез графичен метод, който построи крива по време на време на ензимната реакция. Първоначално скорост се определя като наклона на допирателната съставен от произхода на крива хода на ензимната реакция (вж. Фиг. 8.1).
Когато се работи с определен ензим, времето за реакция трябва да бъде избран на базата на експериментални данни при първоначалното скоростта на реакцията.
В зависимост от задачата, която се изправя срещу изследователи или технолози, тези, които работят с ензими, изберете една или друга подход в тази работа. Това се отнася до следното.
1. Ако е необходимо да се изолират и характеризират ензима на всеки биологичен обект, хранителни суровини, да се прилага всяка схема известно разделяне и пречистване, или за разработване на оптимална схема за ензима чрез вариране и тестване на различни комбинации от основни стъпки за пречистване и изолиране на ензими (протеини): екстракция, утаяване на различни режими, гел хроматография или други методи, основаващи се на различията в физико-химичните характеристики на специфични ензими (вж. също Chap. 2). На всеки етап на разделяне и пречистване на ензимния препарат трябва да се характеризира за ензимна активност и съдържание на протеин. В този случай, определяне на ензимната активност (определяне F0) се провежда като се използва стандартен субстрат; идентифициране на оптимално рН и температура. Все по-нататъшни проучвания, проведени при насищаща концентрация на субстрата, рН и температура оптимално. Изследване на ефекта на специфични активатори и инхибитори позволява в този случай да се получи ценна информация за структурата на активното място и възможен механизъм на каталитично действие. Необходимо е да се подчертае значението на задълбочения методически подход при работа с ензими. да не пестят време и усилия да избере режим на екстракция (продължителност, температура, екстракция средство, вида на екстракция - изчерпателен или не), изборът на методи за определяне на активността, неговото усъвършенстване и възможно модифициране на този конкретен обект на проучване; В допълнение, работа с различни ензими чистота също има своите собствени характеристики, собствен специфичност: те имат различно рН и термична стабилност и, в допълнение, могат да реагират по различен начин на влиянието на различни фактори.
2. Ако задачата е да се определи как ще се държи активен ензим (ензимен препарат) в определен режим счита технология храна, е необходимо да се извършват изследвания ензимно действие при условията на този процес (концентрация на субстрат, продължителност, рН, температура, влажност), да се проучи ефекта на различни хранителни компоненти и суровини, използвани добавки на ензимната активност, за да се определи възможността и начини за въздействие върху процеса на ферментация в желаната употреба НОИ.
Ние сега разгледаме факторите, които влияят на скоростта на ензимни реакции.
Влияние на концентрация на субстрата от скоростта на ензимната реакция. Концентрацията на субстрата е важен фактор при определяне на степента на ензимната реакция. Обратно през 1902. W. Хенри в изследването на ензимната хидролиза на захарозата предполага, че ензим р-fructofuranosidase взаимодейства с неговия субстрат, и след това
съединение се разлага, ензимът остава в първоначалната форма, и захароза субстрат се разцепва в глюкоза и фруктоза.
Това предложение е доразвита от L. Michaelis и М. Menten. През 1913 г. те постулира следното уравнение на ензимната реакция:
където к + 1 - константа на скорост на реакцията за образуване на комплекс ES, К-1, К + 2 - константи реакция процент за разпад на сложните ES в две посоки.
След Ks - константа на дисоциация на комплекса ES е съотношението на гърба и напред постоянни скорости на реакцията:
Източникът на много недоразумения в миналото и в настоящето, е неправилното използване на термина "Михаелис постоянен" и две Ks и Km героите да представляват не-идентични стойности на всички, въпреки много ясна препоръка на Ензим комисия на Международния съюз по биохимия. На -Ks първата стойност - равновесната константа, изразена чрез съотношение Ks = на
Той се характеризира афинитета на ензима към основата (или, алтернативно, ES комплекс сила), където има обратна пропорционалност между размера на К и афинитета на ензима към субстрата. Втората стойност е съответният -Km субстратна концентрация, при която V = Vmax / 2. Често Ks имот погрешно приписва Km. Ха наистина Km ще бъде мярка за афинитета на ензима към субстрата само в един случай, когато стойността на к + 2 е толкова малка, че почти съвпада с Km Ks.
Много ензими катализират реакции, включващи две основи. Така наречените бимолекулни реакции включват химични реакции трансфер групи от едно съединение на друг, реакцията на синтез, редокси реакцията.
Такива реакции могат да се появят по два различни механизми. В реакциите на първия тип, наречени реакции единично заместване, две субстрати А и Форма В ензим сложни EAB, който след това се разлага до образуване реакционни продукти С и D. dvuhsubstratnyh реакцията втори тип протича съгласно механизма на двойно заместване (механизъм на "пинг-понг") , В тези реакции с активния център на ензима във всеки момент от време, свързан само с една от двете повърхности.
В изследване на кинетиката на бимолекулни реакции, концентрацията на един от субстратите е лявата константа (В), а вторият - промяна (А). В този случай, 1 / V координира 1 / [A] може да се получи "очевидно" стойност К т. Истинската стойност Vmax и К Б М е получен в изследването на няколко концентрации на субстрат W. По същия начин, при определяне на получения К m (когато концентрацията на А е константа, и варира в концентрация). Rm по отношение на различните субстрати в същата реакция, може да бъде различна - това се вижда ясно от следния пример.
Реакцията се катализира от алкохол дехидрогеназа:
етанол ацеталдехид
Стойността на Km за алкохолдехидрогеназа на мая: